Vous pouvez faire confiance à Advil aux Liqui-Gels pour soulager rapidement la douleur aiguë de vos patients1,2
Aller à
- La science derrière Advil
- Profil d’innocuité globale et digestive
- Profil d’innocuité cardiovasculaire
- Profil d’innocuité hépatique et rénale
- Efficacité éprouvée en clinique
- Lignes directrices cliniques pour la prise en charge de la douleur aiguë
- Pour les patients à la recherche d’un soulagement des céphalées migraineuses
- Renseignements détaillés sur Advil Liqui-Gels et Advil Mini-Gels1

Advil Liqui-Gels soulage rapidement la douleur aiguë1
Advil Liqui-Gels, dont l’innocuité, l’efficacité et le début d’action rapide ont été démontrés, est offert en version ordinaire, extra-forte et en mini-gels1,3,4.
Advil Mini-Gels procure un soulagement rapide et efficace de la douleur grâce à une capsule plus petite facile à avaler2,3.
Jusqu’à 40 % des Canadiens ont parfois de la difficulté à avaler un comprimé5*; Advil Mini-Gels est offert en un format idéal qui en facilite l’ingestion. Deux capsules Advil Mini-Gels procurent jusqu’à 8 heures de soulagement de la douleur3.
Les produits Advil contiennent de l’ibuprofène, un anti-inflammatoire non stéroïdien2.
* Advil Nielsen BASES Canada5
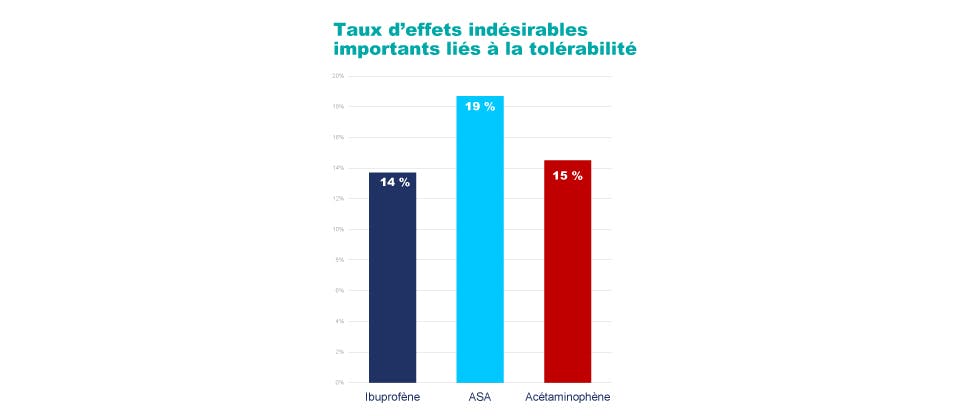
Profil de tolérabilité globale et digestive
Tolérabilité comparative de l’ibuprofène dans le cadre d’un essai clinique à répartition aléatoire d’envergure
Au cours de l’étude PAIN, dont le rapport a été publié dans la revue Clinical Drug Investigation, l’ibuprofène a affiché le profil de tolérabilité globale suivant2,4 :
- Profil statistiquement équivalent à celui de l’acétaminophène
- Profil supérieur à celui de l’acide acétylsalicylique (AAS)
Cet essai d’envergure à répartition aléatoire comparant des doses d’AAS, d’acétaminophène et d’ibuprofène en vente libre auprès de 8677 adultes a permis d’évaluer la fréquence des effets indésirables importants liés à la tolérabilité. Le paramètre d’évaluation principal était le nombre de patients ayant subi au moins un effet indésirable important, défini comme une manifestation grave, sévère ou modérée ayant nécessité une deuxième consultation d’un médecin ou l’arrêt du traitement, ou dont l’intensité n’était pas précisée. L’analyse statistique visait à déterminer l’équivalence entre l’ibuprofène et l’acétaminophène, et la différence entre l’ibuprofène et l’AAS2,4*.
AAS = acide acétylsalicylique* Il s’agissait d’une étude multicentrique menée avec insu dans des cliniques de médecine générale et évaluant, du point de vue des patients avec l’aide des médecins, le traitement par l’AAS, l’acétaminophène (tous deux à une dose maximale de 3 g par jour) et l’ibuprofène (à une dose maximale de 1,2 g par jour), administrés pendant au plus 7 jours pour soulager la douleur associée à des problèmes courants. Au total, 1108 omnipraticiens ont fourni des données relatives à 8677 adultes (2900 traités par l’AAS, 2886 traités par l’ibuprofène et 2888 traités par l’acétaminophène; le dossier de 3 patients ne précisait pas le produit reçu). Les principales indications étaient les douleurs musculo-squelettiques ou dorsales (48 %) et le mal de gorge, le rhume ou la grippe (31 %).
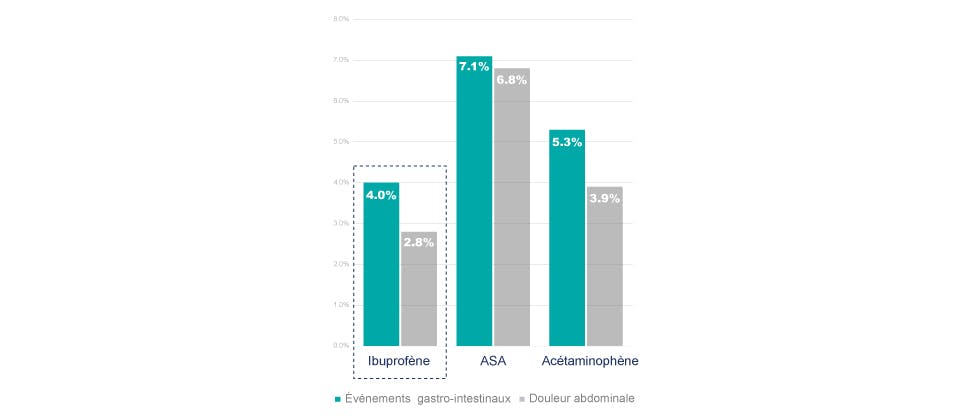
Lorsqu’il est utilisé selon les directives pour traiter la douleur aiguë, l’ibuprofène en vente libre est bien toléré2*
Au cours de l’étude PAIN, à laquelle ont participé plus de 8500 patients, les manifestations digestives (dont la dyspepsie) et la douleur abdominale ont été moins fréquentes avec l’ibuprofène (200 mg) qu’avec l’acide acétylsalicylique (500 mg) ou l’acétaminophène (500 mg) (p < 0,035 dans tous les cas)2,4.
Cet essai d’envergure à répartition aléatoire comparant des doses d’AAS, d’acétaminophène et d’ibuprofène en vente libre auprès de 8677 adultes a permis d’évaluer la fréquence des effets indésirables importants liés à la tolérabilité. Le paramètre d’évaluation principal était le nombre de patients ayant subi au moins un effet indésirable important, défini comme une manifestation grave, sévère ou modérée ayant nécessité une deuxième consultation d’un médecin ou l’arrêt du traitement, ou dont l’intensité n’était pas précisée. L’analyse statistique visait à déterminer l’équivalence entre l’ibuprofène et l’acétaminophène, et la différence entre l’ibuprofène et l’AAS2,4*.
AAS = acide acétylsalicylique* Il s’agissait d’une étude multicentrique menée avec insu dans des cliniques de médecine générale et évaluant, du point de vue des patients avec l’aide des médecins, le traitement par l’AAS, l’acétaminophène (tous deux à une dose maximale de 3 g par jour) et l’ibuprofène (à une dose maximale de 1,2 g par jour), administrés pendant au plus 7 jours pour soulager la douleur associée à des problèmes courants. Au total, 1108 omnipraticiens ont fourni des données relatives à 8677 adultes (2900 traités par l’AAS, 2886 traités par l’ibuprofène et 2888 traités par l’acétaminophène; le dossier de 3 patients ne précisait pas le produit reçu). Les principales indications étaient les douleurs musculo-squelettiques ou dorsales (48 %) et le mal de gorge, le rhume ou la grippe (31 %).
![[Icônes de cerveau et de cœur, accompagnées de texte]](https://i-cf65.ch-static.com/content/dam/cf-consumer-healthcare/health-professionals/fr_CA/pain-relief/advil/CV%20Safety%20Profile_French_970x416.jpg?auto=format)
Profil d’innocuité cardiovasculaire
Le risque cardiovasculaire associé à l’ibuprofène dépend de la dose et n’a pas augmenté avec l’utilisation des doses recommandées des médicaments en vente libre (≤ 1200mg/jour)6‑10 :
| Dose d’ibuprofène | Andersohn et al., 2006 | Garcia-Rodriguez, et al., 2008 | van Staa et al., 2008 | Fosbøl et al., 2009 | McGettigan et Henry, 2011 |
| < 1200 mg/jour | RR : 1,05 (IC à 95 % : 0,91 à 1,22) | ||||
| ≤ 1200 mg/jour | RR : 0,99 (IC à 95 % : 0,81 à 1,21) | RR : 1,00 (IC à 95 % : 0,80 à 1,25) | RRI : 0,92 (IC à 95 % : 0,86 à 0,97) | RR : 1,05 (IC à 95 % : 0,96 à 1,15) |
* L’emploi prolongé continu peut accroître le risque de crise cardiaque ou d’accident vasculaire cérébral2
AINS = anti-inflammatoire non stéroïdien; COX-2 = cyclo-oxygénase-2; IC = intervalle de confiance; RR = risque relatif; RRI = rapport des risques instantanés
† Andersohn et ses collaborateurs ont mené une étude cas-témoins emboîtés au sein d’une cohorte de 486 378 personnes inscrites dans la base de données GPRD (General Practice Research Database) du Royaume-Uni et ayant reçu au moins 1 ordonnance d’un AINS entre le 1er juin 2000 et le 31 octobre 2004. Les rapports des taux d’infarctus du myocarde aigu associés à l’emploi d’un AINS sélectif ou non sélectif de la COX-2 ont été calculés. La durée de chaque ordonnance d’AINS a été déterminée en divisant la quantité de comprimés prescrits par le nombre de comprimés à prendre chaque jour. L’exposition « courante » correspondait à une prescription d’AINS se terminant dans la période de 14 jours précédant la date de référence. L’exposition « récente » correspondait à une provision s’étant epuisée de 15 à 183 jours avant la date de référence, et l’exposition « antérieure » à une provision s’étant épuisée de 184 jours à 1 an avant la date de référence. La non-utilisation était définie par l’absence d’utilisation de quelque AINS que ce soit au cours de l’année ayant précédé la date de référence. Les rapports des taux semblaient augmenter avec les doses quotidiennes plus fortes des inhibiteurs de la COX-2 et étaient plus élevés chez les patients ne présentant aucun facteur de risque cardiovasculaire majeur.
Garcia Rodriguez et ses collaborateurs ont mené une analyse cas-témoins emboîtés dans la population générale des dossiers médicaux de la base de données The Health Improvement Network au Royaume-Uni. Le risque d’infarctus du myocarde a été évalué chez 716 394 personnes âgées de 50 à 84 ans entre janvier 2000 et octobre 2005 (durée moyenne du suivi : 4,1 ans). L’exposition aux AINS était qualifiée de « courante » si la plus récente ordonnance procurait des provisions jusqu’à la date de référence (jour de l’apparition du premier signe ayant mené à l’hospitalisation) ou prenait fin dans les 7 jours précédant la date de référence; de « récente » si l’ordonnance prenait fin de 8 à 90 jours avant la date de référence; d’« antérieure » si l’ordonnance prenait fin de 91 à 365 jours avant la date de référence; et de « nulle » si aucune utilisation d’un AINS n’avait été consignée dans l’année précédant la date de référence. L’exposition courante était subdivisée en trois catégories : « unique » lorsque le sujet avait utilisé un seul AINS au cours du mois précédant la date de référence; « multiple » lorsque le sujet avait utilisé au moins 2 AINS différents au cours de la semaine précédant la date de référence; et « successive » lorsque le sujet avait utilisé un seul AINS au cours de la semaine précédant la date de référence, mais qu’il avait aussi utilisé au moins un autre AINS dans les 8 à 30 jours précédant la date de référence.
van Staa et ses collaborateurs ont mené une étude de cohorte rétrospective qui regroupait 729 294 patients de la base de données GPRD (General Practice Research Database) du Royaume-Uni. L’étude évaluait le RR d’infarctus du myocarde chez les patients qui étaient âgés de ≥ 40 ans au moment où ils ont reçu une première ordonnance d’un AINS. Les données de 1987 à 2006 ont été incluses dans cette étude, et la durée médiane du suivi des sujets de la cohorte AINS était de 6,1 ans. Les patients ont fait l’objet d’un suivi entre la première ordonnance d’un AINS (date de référence) et le moment de leur décès, l’orientation vers un spécialiste, la dernière date à laquelle les données de la base GPRD étaient disponibles pour l’étude (premier trimestre de 2006) ou la date de la première ordonnance d’un AINS sélectif de la COX-2, selon la première de ces éventualités.La période totale de suivi des utilisateurs d’AINS a été divisée en deux périodes, soit « l’exposition courante » et « l’exposition antérieure », les patients passant d’un groupe à l’autre en fonction de leur utilisation d’un AINS. L’exposition courante correspondait à la période allant de la date de la prescription d’un AINS jusqu’à la fin de la durée prévue de l’utilisation, plus 3 mois. La durée prévue de l’utilisation d’un AINS a été estimée à partir de la dose quotidienne prescrite par l’omnipraticien et du nombre de comprimés d’AINS.
Fosbøl et ses collaborateurs ont mené une étude de cohorte historique pour évaluer le risque d’infarctus du myocarde et de décès associé à l’utilisation d’AINS à partir des données relatives à plus de 1 million de Danois en bonne santé âgés de plus de 10 ans. Une bonne santé correspondait à l’absence d’antécédents d’admission à l’hôpital et de prise concomitante de certains médicaments (la liste complète de ces médicaments est fournie dans le rapport de l’étude). Les AINS ont été utilisés pendant une période de 9 à 34 jours.
McGettigan et Henry ont réalisé une revue systématique des études d’observation contrôlées menées dans la communauté pour déterminer les risques cardiovasculaires associés aux AINS. La revue incluait 38 études portant sur l’ibuprofène. La prescription d’un AINS était considérée comme « courante » si elle couvrait une période incluant la date de référence (le jour de la survenue de la manifestation indésirable d’origine cardiaque) ou si elle se terminait une semaine ou moins avant la date de référence. Les résultats étudiés comprenaient l’infarctus du myocarde, le décès par coronaropathie ou un critère composite comprenant l’infarctus du myocarde et le décès par coronaropathie.
![[Icônes de foie et de reins, accompagnées de texte]](https://i-cf65.ch-static.com/content/dam/cf-consumer-healthcare/health-professionals/fr_CA/pain-relief/advil/Hepatic%20and%20Renal%20Safety_FRENCH_970x416.jpg?auto=format)
Profil d’innocuité hépatique et rénale
Selon des études cliniques, l’ibuprofène serait moins susceptible d’entraîner des lésions hépatiques aiguës que les autres AINS :
Archives of Internal Medicine, 1994 (Garcia Rodriguez LA et al.)
- Parmi les 8 AINS étudiés, c’est l’ibuprofène qui a été associé à la plus faible incidence de lésions hépatiques, soit 1,6 cas pour 100 000 utilisateurs. L’incidence associée aux autres AINS était la suivante (par ordre croissant) : diclofénac par voie orale (3,6/100 000), naproxène (3,8/100 000), acide méfénamique (2,5/100 000), kétoprofène (8,8/100 000), piroxicam (6,0/100 000), fenbufène (11,9/100 000), sulindac (148,1/100 000)2,15†.
Postgraduate Medicine, 2018 (Moore N et al.)
- Comparativement à l’ibuprofène, le risque d’hépatotoxicité est un peu plus élevé et mieux documenté avec l’acétaminophène, et selon les données rapportées, il est plus élevé avec certains AINS, comme le diclofénac administré par voie orale et le sulindac11†.
Selon des études épidémiologiques, l’ibuprofène à faible dose (≤ 1200 mg par jour) ne semble pas associé à un risque accru d’effets indésirables rénaux (p. ex. insuffisance rénale ou lésions rénales)12,13‡.
American Journal of Epidemiology, 2000 (Griffin MR et al.)
- L’utilisation d’ibuprofène à des doses ≤ 1200 mg/jour a été associée à un rapport des risques instantanés de 0,94 (IC à 95 % : 0,58 à 1,51) pour les EI rénaux (insuffisance rénale)12†.
Pharmacotherapy, 1999 (Perez-Gutthann S et al.)
- Aucun effet indésirable majeur lié à des lésions rénales (insuffisance rénale aiguë) n’a été observé durant l’étude13†.
Pharmacotherapy, 1992 (Furey SA et al.)
- Les lésions rénales (insuffisance rénale aiguë ou toute autre lésion rénale) ne comptaient pas parmi les effets indésirables signalés après la prise de doses d’ibuprofène en vente libre14†..
AINS = anti-inflammatoire non stéroïdien; IC = intervalle de confiance
† Garcia Rodriguez et ses collaborateurs ont mené une étude de cohorte rétrospective comprenant une analyse cas-témoins secondaire. L’étude incluait 536 cabinets de médecine générale en Angleterre et au Pays de Galles pour la période allant d’octobre 1987 à août 1991. Un total de 625 307 personnes qui ont reçu plus de 2 millions d’ordonnances pour un des 12 AINS ont fait l’objet d’un suivi visant à estimer le risque de nouvelle lésion hépatique aiguë. L’incidence des lésions hépatiques aiguës chez les utilisateurs d’AINS était de 3,7 sur 100 000. Le sulindac était le seul AINS associé à un risque de lésions hépatiques aiguës considérablement plus élevé que celui associé à l’ensemble des AINS. L’incidence des lésions hépatiques aiguës chez les utilisateurs d’indométacine, de diflunisal, de ténoxicam et de fénoprofène n’a pas été précisée. Les auteurs de l’étude concluent que le risque de lésions hépatiques aiguës associé à la plupart des AINS est assez faible pour ne pas être préoccupant.
Moore et ses collaborateurs ont passé en revue les données publiées sur l’innocuité digestive et hépatique de différents analgésiques en vente libre autres que l’aspirine, y compris des AINS (ibuprofène, kétoprofène, diclofénac et naproxène) et l’acétaminophène. L’innocuité en cas de surdosage a aussi été évaluée. Les articles décrivant des essais cliniques, des méta-analyses et des études épidémiologiques ont été évalués aux fins d’inclusion dans la revue; les auteurs se sont surtout intéressés aux études portant sur des doses et des durées d’utilisation correspondant à celles qui sont recommandées pour les produits en vente libre. Les effets digestifs représentaient 75 % de l’ensemble des EI observés dans les études. Dans toutes les études présentées ici, le risque d’effets toxiques digestifs graves, y compris les saignements gastro-intestinaux hauts et les ulcères gastroduodénaux, était faible aux doses recommandées pour les produits en vente libre.
Griffin et ses collaborateurs ont réalisé une étude cas-témoins emboîtés auprès des personnes âgées de ≥ 65 ans inscrites au programme Medicaid du Tennessee, afin de déterminer le rôle des AINS dans la détérioration aiguë de la fonction rénale. Les cas étudiés comprenaient des patients qui avaient été hospitalisés pour une insuffisance rénale aiguë acquise dans la collectivité. Dans le cas de l’ibuprofène, le rapport des cotes associé à une dose ≤ 1200 mg/jour était de 0,94 (IC à 95 % : 0,58 à 1,51) et augmentait en fonction de la dose (il était de 1,89 [IC à 95 % : 1,34 à 2,67] pour les doses allant de plus de 1200 à moins de 2400 mg/jour, et de 2,32 [IC à 95 % : 1,45 à 3,71]) pour les doses supérieures à 2400 mg/jour. Les chercheurs ont recensé toutes les ordonnances exécutées pour ces médicaments dans les 365 jours précédant la date de référence (date de la première hospitalisation des patients) : 6 % des utilisateurs courants d’un AINS avaient commencé à prendre ce médicament dans les 30 jours précédents; 33 % avaient utilisé un AINS pendant moins de 180 jours au cours de l’année précédente; et 61 % avaient utilisé un AINS pendant plus de 180 jours.
Pérez-Gutthann et ses collaborateurs ont mené une étude de cohorte au Royaume-Uni afin d’évaluer le risque de survenue d’un nouvel épisode de saignement gastro-intestinal haut, d’insuffisance hépatique ou rénale aiguë, d’agranulocytose, d’anémie aplasique, d’affections cutanées graves et d’anaphylaxie dans les 30 jours suivant la première ordonnance de diclofénac pour administration orale, de naproxène ou d’ibuprofène à faible dose. Au total, on dénombrait 22 146 utilisateurs de diclofénac (≤ 75 mg), 46 919 utilisateurs de naproxène (≤ 750 mg) et 54 830 utilisateurs d’ibuprofène (≤ 1200 mg). L’âge, le sexe et les affections concomitantes étaient comparables dans les 3 cohortes, qui étaient constituées d’hommes et de femmes âgés de 15 à 85 ans. Parmi les 54 830 sujets ayant utilisé l’ibuprofène (≤ 1200 mg/jour) dans l’étude, il y a eu 2 cas d’atteinte hépatique. Un seul cas d’insuffisance rénale potentiellement mortel a été rapporté chez un utilisateur de naproxène, et aucun chez les utilisateurs d’ibuprofène.
Furey et ses collaborateurs ont évalué l’innocuité de doses uniques des différentes teneurs d’ibuprofène en vente libre en examinant les effets indésirables signalés au cours de 15 essais à répartition aléatoire, contrôlés et à double insu portant sur l’utilisation du médicament dans le traitement de différentes affections douloureuses courantes (p. ex. céphalée, mal de gorge). Toutes les études comprenaient un placebo et un autre analgésique en vente libre, l’acétaminophène. Au total, 878 sujets ont reçu l’ibuprofène à 200 mg (n = 171) ou à 400 mg (n = 707), 849 ont reçu l’acétaminophène à 650 mg (n = 237) ou à 1000 mg (n = 612), et 852 ont reçu un placebo. Les sujets étaient âgés de 16 à 79 ans, présentaient divers problèmes de douleur, mais étaient par ailleurs en bonne santé. Selon les données rapportées, aucun EI rénal n’a été signalé; les effets indésirables étaient principalement associés au tractus gastro-intestinal et au système nerveux central).
‡ L’innocuité de l’ibuprofène utilisé selon les directives à une faible dose (≤ 1200 mg/jour) et pendant une courte période a été démontrée. Advil ne doit pas être utilisé durant plus de 3 jours pour la fièvre ni plus de 5 jours pour la douleur, sauf sur l’avis d’un médecin. Veuillez consulter la monographie du produit pour obtenir des renseignements complets sur la posologie et le profil d’innocuité.
Comme les autres AINS, l’ibuprofène bloque la synthèse des prostaglandines rénales, ce qui peut compromettre la fonction rénale et causer une rétention sodique. Le débit sanguin rénal et le taux de filtration glomérulaire ont diminué chez des patients atteints d’insuffisance rénale légère qui ont pris 1200 mg d’ibuprofène par jour pendant une semaine.
Le risque de toxicité rénale est le plus élevé chez les patients qui présentent une dysfonction rénale, de l’insuffisance cardiaque ou une dysfonction hépatique, ou qui prennent des diurétiques, ainsi que chez les personnes âgées. La prudence est de mise lors de l’emploi d’ibuprofène chez les patients présentant un risque de toxicité rénale ou atteints d’affections prérénales. Pour obtenir des renseignements complets sur l’innocuité, veuillez consulter les mises en garde et précautions ainsi que les effets indésirables décrits dans la monographie du produit.

Efficacité éprouvée en clinique pour soulager la douleur aiguë légère ou modérée2
De nombreuses données publiées montrent l’efficacité des doses de 200 et 400 mg d’ibuprofène pour le traitement de la douleur légère ou modérée dans un éventail de modèles de douleur2.
Un seul comprimé d’Advil est souvent tout ce qu’il faut pour soulager la douleur aiguë légère ou modérée, notamment 2 :
- les maux de gorge
- les céphalées et la migraine
- les douleurs musculaires
- les douleurs menstruelles
- les maux de dents
Advil réduit aussi la fièvre.

Efficacité éprouvée en clinique pour soulager les céphalées
L’efficacité d’Advil (doses de 200 mg et 400 mg) pour soulager les céphalées a été éprouvée en clinique2.
Journal of Clinical Pharmacology, 1996 (Schachtel BP et al.)
- Une étude à répartition aléatoire et à double insu comparant l’ibuprofène à 400 mg (n = 153) avec l’acétaminophène à 1000 mg (n = 151) et un placebo (n = 151) a révélé que l’ibuprofène est significativement plus efficace pour soulager la douleur causée par les céphalées que l’acétaminophène à 1000 mg et le placebo. Les sujets ayant reçu l’ibuprofène à 400 mg ont fait état d’une disparition significativement plus rapide de la douleur (1, 2, 3 ou 4 heures après la prise de la dose) que ceux ayant reçu l’acétaminophène à 1000 mg. Plus de trois fois plus de sujets ayant reçu l’ibuprofène à 400 mg que de sujets ayant reçu l’acétaminophène à 1000 mg ont affirmé ne plus ressentir de douleur 3 heures après la prise de la dose16*.
Headache, 1988 (Schachtel BP et al.)
- Les données d’une étude avec répartition aléatoire menée à double insu comparant l’ibuprofène à 400 mg (n = 35) avec un placebo démontrent que l’ibuprofène exerce un effet analgésique important se manifestant en moins de 30 minutes dans les cas de céphalée (n = 35)17†.
* 30 minutes et 1, 2, 3 et 4 heures après la prise d’une dose, tous les patients ont rempli les échelles d’évaluation de l’intensité de la douleur causée par la céphalée et du soulagement de la douleur causée par la céphalée.† Soixante-dix sujets répondaient aux critères d’admission; il s’agissait d’hommes (21 dans le groupe de traitement et 15 dans le groupe placebo) et de femmes (15 dans le groupe de traitement et 20 dans le groupe placebo) dont l’âge moyen était d’environ 21 ans, à qui on avait demandé de consigner dans un journal toutes leurs céphalées de tension. Chaque fois qu’ils avaient mal à la tête, ils devaient prendre une seule dose du médicament à l’étude. Ils évaluaient ensuite l’efficacité du médicament 15, 30, 45, 60, 90 et 120 minutes après la prise de la dose.
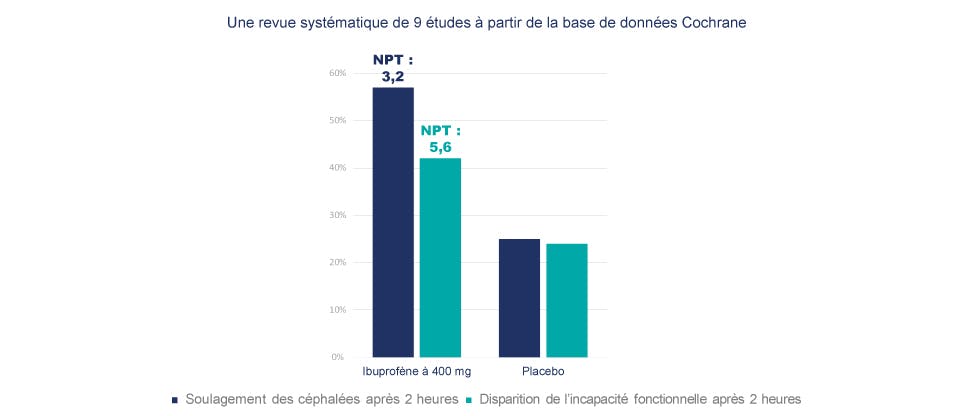
Efficacité éprouvée en clinique pour soulager la douleur causée par la migraine2,18
L’efficacité de l’ibuprofène à 400 mg pour soulager la douleur liée aux céphalées migraineuses et atténuer l’incapacité fonctionnelle connexe a été éprouvée en clinique18*.
Cochrane Database of Systematic Reviews, 2013 (Rabbie R et al.)
- Les données issues de 9 études menées auprès de sujets ayant reçu un diagnostic de migraine et dont la plupart éprouvaient des symptômes de migraine depuis au moins 12 mois au moment de leur admission à l’étude ont été analysées18.
- La proportion des sujets ressentant un soulagement de la céphalée 2 heures après la prise d’une dose d’ibuprofène à 400 mg était de 57 %, comparativement à 25 % dans le cas des sujets sous placebo18†.
- La proportion de sujets présentant une diminution de l’incapacité fonctionnelle associée à la céphalée 2 heures après la prise d’une dose d’ibuprofène à 400 mg était de 42 %, comparativement à 24 % dans le cas des sujets sous placebo18‡.
* Les sujets admis à l’étude avaient tous reçu un diagnostic de céphalées migraineuses selon les critères de l’International Headache Society. Ils étaient âgés en moyenne de 30 à 40 ans, selon l’étude.† Ibuprofène : 57 % (528/931; min.-max. : 41-72 %) des sujets; placebo : 25 % (224/884; min.-max. : 7-50 %) des sujets.‡ Ibuprofène : 42 % (245/583; min.-max. : 18-76 %) des sujets ont présenté une dimnution de l’incapacité fonctionnelle 2 heures après la prise d’une dose d’ibuprofène à 400 mg. La proportion était de 24 % (129/531; min.-max. : 13-55 %) dans le cas des sujets ayant pris un placebo.

Affections douloureuses aiguës courantes et analgésiques en vente libre recommandés d’après les données probantes19
| Affection | Analgésique recommandé selon les données probantes |
| Maux de dos | Anti-inflammatoire non stéroïdien (AINS, p. ex. ibuprofène à 400 mg 3 fois par jour) à la dose la plus faible possible, sur la plus courte période possible |
| Migraine (diagnostiquée par un médecin)* | AINS (p. ex. ibuprofène) ou acétaminophène en monothérapie, en tenant compte des affections concomitantes |
| Céphalée de tension | Aspirine (300 mg trois fois par jour), acétaminophène ou AINS, en tenant compte de la préférence du patient et des affections concomitantes |
| Entorses et foulures | Acétaminophène (de 500 mg à 1 g quatre fois par jour, jusqu’à concurrence de 4 g en 24 heures) ou AINS topique (p. ex. gel contenant de l’ibuprofène ou du diclofénac) en première intention. Envisager un AINS par voie orale (p. ex. ibuprofène à 400 mg trois fois par jour) 48 heures après la survenue de la blessure, au besoin. |
| Douleurs menstruelles | AINS (p. ex. ibuprofène ou naproxène), sauf en cas de contre-indication. L’acétaminophène peut être utilisé si un AINS est contre-indiqué ou s’il ne parvient pas à soulager la douleur. |
OMS = Organistion mondiale de la Santé* La migraine doit avoir été diagnostiquée par un médecin pour qu’un médicament en vente libre puisse être recommandé.
![[Photo d’une athlète]](https://i-cf65.ch-static.com/content/dam/cf-consumer-healthcare/health-professionals/fr_CA/pain-relief/advil/Jane_970x416.png?auto=format)
Janie a besoin d’un soulagement rapide et efficace de la douleur causée par ses migraines
Janie* n’arrête jamais. Elle s’efforce de maintenir un équilibre entre le travail, la famille, les voyages et les amis. Elle est active et optimiste. Quand la migraine commence à la ralentir, elle a besoin d’un soulagement rapide.
Sa douleur : la migraine
Advil Liqui-Gels procure un soulagement rapide de la douleur, y compris les douleurs associés à la migraine et à ses symptômes1,2.
L’efficacité de l’ibuprofène à des doses de 200 mg† et de 400 mg pour soulager les douleurs causées par la céphalée migraineuse et atténuer l’incapacité fonctionnelle connexe a été éprouvée en clinique19.
* Cas fictif† Sauf Advil Mini-Gels
Recommandez Advil à vos patients pour soulager la douleur aiguë

Advil Liqui-Gels
Advil Liqui-Gels procure un soulagement rapide de la douleur aiguë1. Offert en version ordinaire, extra-forte et en mini-gels1,3,4.
Advil – pour répondre à tous les besoins de vos patients en matière de soulagement de la douleur aiguë

Advil – pour répondre à tous les besoins de vos patients en matière de soulagement de la douleur aiguë
Apprenez-en plus au sujet de la gamme de produits Advil.