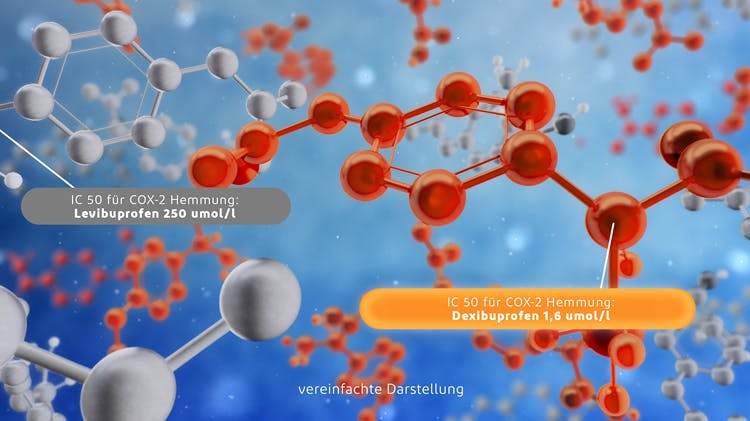
Voltaren – wissenschaftliche Basis der Schmerzlinderung
Die wissenschaftliche Basis der Voltaren Produkte zur Schmerzlinderung.
SIE VERLASSEN DIE SEITE
Sie verlassen nun die Website und wechseln zu einer externen Website, die unabhängig von Haleon betrieben und nicht von Haleon verwaltet wird. Haleon übernimmt keine Verantwortung für die Website. Wenn Sie die Seite nicht verlassen möchten, klicken Sie auf "Abbrechen".
Die wissenschaftliche Basis der Voltaren Produkte zur Schmerzlinderung.
Dieser Text richtet sich an medizinisches und pharmazeutisches Fachpersonal in Deutschland.
Marken sind Eigentum der Haleon Unternehmensgruppe oder an diese lizenziert. Haleon Germany GmbH, Barthstraße 4, 80339 München, Geschäftsführer: Konstantinos Limnidis, Roman Wüllner. © 2025 Haleon oder Lizenzgeber
VoltaDexibu Schmerztabletten 200 mg Filmtabletten Wirkstoff: Dexibuprofen. Zusammensetzung: Eine Filmtablette enthält 200 mg Dexibuprofen. Sonstige Bestandteile: Tablettenkern: Hypromellose, mikrokristalline Cellulose, Carmellose Calcium, hochdisperses Siliciumdioxid, Talkum; Filmüberzug: Hypromellose, Titandioxid (E 171), Triacetin, Macrogol 6000. Anwendungsgebiete: Bei Erwachsenen zur symptomatischen kurzzeitigen Behandlung von akuten leichten bis mäßig starken Schmerzen wie Zahnschmerzen, Regelschmerzen, Kopfschmerzen. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff, gegen andere NSAR oder einen der sonstigen Bestandteile; Patienten, bei denen Stoffe mit ähnlicher Wirkung (z.B. Acetylsalicylsäure oder andere NSAR) Asthmaanfälle, Bronchospasmen, akute Rhinitis, Nasenpolypen, Urtikaria oder angioneurotische Ödeme auslösen; Gastrointestinale Blutungen oder Perforationen in der Anamnese im Zusammenhang mit einer vorherigen Behandlung mit NSAR; Bestehende oder in der Vergangenheit wiederholt aufgetretene peptische Ulzera oder Blutungen (mindestens zwei voneinander unabhängige Episoden von nachgewiesener Ulzeration oder Blutung); Ungeklärte Blutbildungsstörungen; Zerebrovaskuläre oder andere aktive Blutungen; Aktiver Morbus Crohn oder aktive Colitis ulcerosa; Schwere Herzinsuffizienz (NYHA-Klasse IV); Schwere Nierenfunktionsstörung (GFR < 30 ml/min); Starke Dehydratisierung (z. B. durch Erbrechen, Durchfall oder unzureichende Flüssigkeitsaufnahme); Schwere Leberfunktionsstörung; Ab dem sechsten Monat der Schwangerschaft. Nebenwirkungen: Häufig: Gastrointestinale Beschwerden wie Bauchschmerzen, Übelkeit, Dyspepsie, Diarrhoe, Blähungen, Verstopfung, Sodbrennen, Erbrechen und geringfügige Magen-Darm-Blutverluste, die in Ausnahmefällen eine Anämie verursachen können. Gelegentlich: Überempfindlichkeitsreaktionen mit Hautausschlägen und Hautjucken sowie Asthmaanfällen (ggf. mit Blutdruckabfall); Zentralnervöse Störungen wie Kopfschmerzen, Schwindel, Schlaflosigkeit, Erregung, Reizbarkeit oder Müdigkeit; Sehstörungen; Gastrointestinale Ulzera, Perforation oder Magen-Darm-Blutung, Gastritis, ulzerative Stomatitis, Exazerbation einer Colitis und eines Morbus Crohn; Hautausschläge; Rhinitis. Selten: Tinnitus, Hörstörungen nach längerer Behandlung; Nierengewebeschädigungen (Papillennekrose) und erhöhte Harnstoffkonzentration im Blut; Erhöhte Harnsäurekonzentration im Blut; Leberfunktionsstörungen (in der Regel reversibel). Sehr selten: Infektionsbedingte Entzündungen (z. B. Entwicklung einer nekrotisierenden Fasziitis) können im Zusammenhang mit der Anwendung von NSAR verstärkt werden; Störungen der Blutbildung (Anämie, Leukopenie, Thrombozytopenie, Panzytopenie, Agranulozytose); Schwere allgemeine Überempfindlichkeitsreaktionen (Gesichtsödem, Zungenschwellung, innere Kehlkopfschwellung mit Einengung der Luftwege, Luftnot, Herzjagen und Blutdruckabfall bis hin zum lebensbedrohlichen Schock), Verschlimmerung von Asthma; Psychotische Reaktionen, Depression; Aseptische Meningitis; Ödeme, Palpitationen, Herzinsuffizienz; Arterielle Hypertonie, Vaskulitis; Ösophagitis, Pankreatitis, Ausbildung intestinaler, diaphragmaartiger Strikturen; Schwere Hautreaktionen (einschließlich Erythema multiforme, exfoliative Dermatitis, Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse), Alopezie, Lichtempfindlichkeitsreaktionen; Bronchospasmen (vorwiegend bei Asthmapatienten), Asthmaexazerbation; Ausbildung von Ödemen, insbesondere bei Patienten mit arterieller Hypertonie oder Niereninsuffizienz, interstitielle Nephritis, nephrotisches Syndrom oder Niereninsuffizienz, bei länger dauernder Behandlung sollte die Nierenfunktion regelmäßig kontrolliert werden; Hepatische Dysfunktion, Leberschäden, insbesondere bei der Langzeittherapie, Leberversagen, akute Hepatitis und Gelbsucht. Nicht bekannt: Kounis-Syndrom; Arzneimittelreaktion mit Eosinophilie und systemischen Symptomen (DRESS), akute generalisierte exanthematische Pustulose (AGEP). Warnhinweis: Ohne ärztlichen Rat nicht länger anwenden als in der Packungsbeilage vorgegeben! Apothekenpflichtig. Stand: 04/2024 Haleon Germany GmbH, 80258 München
Voltaren Actigo Schmerzgel 11,6 mg/g Gel Wirkstoff: Diclofenac-N-Ethylethanamin. Zusammensetzung: 1 g Gel enthält 11,6 mg Diclofenac-N-Ethylethanamin (entspr. 10 mg Diclofenac-Natrium); Sonstige Bestandteile: gereinigtes Wasser; 2-Propanol; Propylenglycol; Cocoylcaprylocaprat (Ph.Eur.); Paraffin; Cetomacrogol; Carbomer 974 P; N-Ethylethanamin; Parfumcreme (enthält Benzylbenzoat). Anwendungsgebiete: Erwachsene und Jugendliche ab 14 Jahren: Zur lokalen, symptomatischen Behandlung von Schmerzen bei akuten Prellungen, Zerrungen oder Verstauchungen infolge eines stumpfen Traumas, z. B. Sport- und Unfallverletzungen. Bei Jugendlichen ab 14 Jahren ist das Arzneimittel zur Kurzzeitbehandlung vorgesehen. Gegenanzeigen: Voltaren Actigo Schmerzgel darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff, Benzylbenzoat, Benzylalkohol, Citral, Citronellol, Cumarin, D-Limonen, Eugenol, Farnesol, Geraniol, Linalool oder einen der sonstigen Bestandteile des Arzneimittels; von Patienten mit bekannter Überempfindlichkeit gegen Acetylsalicylsäure oder nicht-steroidale Antiphlogistika (NSAIDs), die sich in Form von Asthmaanfällen, Bronchospasmus, Urtikaria, akuter Rhinitis oder Angioödem äußern kann; auf offenen Verletzungen, Entzündungen oder Infektionen der Haut sowie auf Ekzemen oder Schleimhäuten; im letzten Trimenon der Schwangerschaft; bei Kindern und Jugendlichen unter 14 Jahren. Nebenwirkungen: Häufig: Hautausschlag, Ekzem, Erythem, Dermatitis (einschließlich Kontaktdermatitis), Pruritus; Gelegentlich: Schuppenbildung, Austrocknen der Haut, Ödem; Selten: Bullöse Dermatitis; Sehr selten: pustelartiger Hautausschlag; Überempfindlichkeitsreaktionen (einschließlich Urtikaria); Angioödem; Asthma; Gastrointestinale Beschwerden; Photosensibilisierung; Häufigkeit nicht bekannt: Bei großflächiger Anwendung über einen längeren Zeitraum kann es zu systemischen Nebenwirkungen kommen. Benzylbenzoat, Benzylalkohol, Citral, Citronellol, Cumarin, D-Limonen, Eugenol, Farnesol, Geraniol und Linalool können allergische Reaktionen hervorrufen. Warnhinweis: Enthält Propylenglycol und einen Duftstoff mit Benzylbenzoat, Benzylalkohol, Citral, Citronellol, Cumarin, D-Limonen, Eugenol, Farnesol, Geraniol, Linalool.
Apothekenpflichtig. Stand: 03/2024 Haleon Germany GmbH, 80258 München
Voltaren Dolo 25 mg überzogene Tablette Wirkstoff: Diclofenac-Kalium. Voltaren Dolo Liquid 25 mg Weichkapsel Wirkstoff: Diclofenac-Kalium. Zusammensetzung: 1 überzogene Tablette/Weichkapsel enthält 25 mg Diclofenac-Kalium. Sonstige Bestandteile überzogene Tablette: Tricalciumphosphat, Carboxymethylstärke-Natrium (Typ A), mikrokristalline Cellulose, Eisen(III)-oxid (E 172), Macrogol (8000), Magnesiumstearat, Maisstärke, Povidon (K 30), Saccharose, hochdisperses Siliciumdioxid, Talkum, Titandioxid (E 171). Sonstige Bestandteile Weichkapsel: Macrogol 600; Gelatine; Glycerol 85 %; gereinigtes Wasser; Sorbitol flüssig, partiell dehydratisiert (enthält Sorbitan; Mannitol); Farbstoff (E 104). Anwendungsgebiete: Überzogene Tablette: Zur symptomatischen Behandlung von leichten bis mäßig starken Schmerzen. Weichkapsel: Zur symptomatischen Behandlung von leichten bis mäßig starken Schmerzen; Fieber. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile; Bei ungeklärten Blutbildungs- und Blutgerinnungsstörungen; Bestehende gastrale oder intestinale Ulzera, Blutungen oder Perforation; Gastrointestinale Blutungen oder Perforation in der Anamnese im Zusammenhang mit einer vorherigen Therapie mit nichtsteroidalen Antirheumatika (NSAR). Bestehende oder in der Vergangenheit wiederholt aufgetretene peptische Ulzera oder Hämorrhagien (mindestens 2 unterschiedliche Episoden nachgewiesener Ulzeration oder Blutung); Letztes Trimenon der Schwangerschaft; Schwere Leberinsuffizienz; Schwere Niereninsuffizienz (GFR ≤ 29 mL/min/1.73 m2); Bekannte Herzinsuffizienz (NYHA II–IV), ischämische Herzkrankheit, periphere arterielle Verschlusskrankheit und/oder zerebrovaskuläre Erkrankung; Wie andere NSAR ist Diclofenac auch bei Patienten kontraindiziert, bei denen die Einnahme von Acetylsalicylsäure oder anderen NSAR Asthmaanfälle, Urtikaria, Angioödeme oder akute Rhinitis ausgelöst hat. Nebenwirkungen: Sehr häufig: Übelkeit, Erbrechen, Diarrhö, geringfügige Magen-Darm-Blutverluste, die in Ausnahmefällen eine Anämie verursachen können. Häufig: Kopfschmerzen, Erregung, Müdigkeit, Benommenheit; Vertigo (Schwindel); Dyspepsie, Bauchschmerz, Blähungen, verminderter Appetit, gastrointestinale Ulzera (mit oder ohne Blutung oder Perforation); Transaminasenerhöhung; Exanthem. Gelegentlich: Herzinfarkt, Herzinsuffizienz, Palpitationen, Brustschmerz. Selten: Anaphylaktische und anaphylaktoide Reaktionen (einschließlich Hypotonie und Schock), Überempfindlichkeit; Somnolenz; Asthma (einschließlich Dyspnoe); Gastrointestinale Blutung, Hämatemesis, hämorrhagische Diarrhö, Teerstuhl, Gastritis; Hepatitis, Gelbsucht, Leberfunktionsstörung; Urtikaria; Ödeme, besonders bei Patienten mit hohem Blutdruck oder eingeschränkter Nierenfunktion. Sehr selten: Agranulozytose, Anämie (einschließlich hämolytische Anämie und aplastische Anämie), Leukopenie, Thrombozytopenie; Angioödem (einschließlich Gesichtsödem); Psychotische Erkrankung, Desorientierung, Depression, Schlaflosigkeit, Albträume, Reizbarkeit; Schlaganfall, aseptische Meningitis mit Nackensteifigkeit, Kopfschmerzen, Übelkeit, Erbrechen, Fieber oder Bewusstseinstrübung - prädisponiert scheinen Patienten mit Autoimmunerkrankungen (systemischem Lupus erythematodes, Mischkollagenosen) zu sein, Krämpfe, Angstgefühle, Gedächtnisstörung, Tremor, Empfindungsstörung, Dysgeusie (Geschmacksstörungen); Sehstörung, verschwommenes Sehen, Diplopie; Hörstörung, Tinnitus; Hypertonie, Vaskulitis; Pneumonitis; Colitis (einschließlich hämorrhagische Colitis und Exazerbation einer Colitis Ulcerosa oder eines Morbus Crohn), Pankreatitis, Ösophaguserkrankung, diaphragmaartige intestinale Strikturen, Obstipation, Stomatitis (einschließlich ulzerativer Stomatitis), Glossitis; Leberversagen, fulminante Hepatitis, Lebernekrose; Toxische epidermale Nekrolyse (Lyell-Syndrom), Stevens-Johnson-Syndrom, Erythema multiforme, bullöse Dermatitis, Dermatitis exfoliativa, Purpura, Ekzeme, Erytheme, Haarausfall, Photosensibilitätsreaktion, Pruritus; Akutes Nierenversagen, Papillennekrose, interstitielle Nephritis, nephrotisches Syndrom, Hämaturie, Proteinurie; Sehr selten ist im zeitlichen Zusammenhang mit der systemischen Anwendung von NSAR eine Verschlechterung infektionsbedingter Entzündungen (z. B. Entwicklung einer nekrotisierenden Fasciitis) beschrieben worden. Dies steht möglicherweise im Zusammenhang mit dem Wirkmechanismus der NSAR. Wenn während der Anwendung von Diclofenac Zeichen einer Infektion neu auftreten oder sich verschlimmern, wird dem Patienten daher empfohlen, unverzüglich den Arzt aufzusuchen. Es ist zu prüfen, ob die Indikation für eine antiinfektiöse/antibiotische Therapie vorliegt. Nicht bekannt: Kounis-Syndrom; Ischämische Kolitis. Peptische Ulzera, Verstopfung können auftreten. Warnhinweis: Bei Schmerzen oder Fieber ohne ärztlichen Rat nicht länger anwenden als in der Packungsbeilage vorgegeben! Überzogene Tablette: Enthält Saccharose (Zucker). Weichkapsel: Enthält Sorbitol. Apothekenpflichtig. Stand: 01/2024 Haleon Germany GmbH, 80258 München
Voltaren Schmerzgel forte 23,2 mg/g Gel Wirkstoff: Diclofenac-N-Ethylethanamin. Zusammensetzung: 1 g Gel enthält 23,2 mg Diclofenac-N-Ethylethanamin (entspr. 20 mg Diclofenac-Natrium); Sonstige Bestandteile: gereinigtes Wasser; 2-Propanol; Propylenglycol; Cocoylcaprylocaprat (Ph.Eur.); Paraffin; Macrogolcetylstearylether; Carbomer; N-Ethylethanamin; Oleylalkohol; eukalyptushaltiges Parfum; Butylhydroxytoluol. Anwendungsgebiete: Erwachsene und Jugendliche ab 14 Jahren: Zur lokalen, symptomatischen Behandlung von Schmerzen bei akuten Prellungen, Zerrungen oder Verstauchungen infolge eines stumpfen Traumas, z. B. Sport- und Unfallverletzungen. Bei Jugendlichen ab 14 Jahren ist das Arzneimittel zur Kurzzeitbehandlung vorgesehen. Gegenanzeigen: Voltaren Schmerzgel forte darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff, Benzylalkohol, Citronellol, Cumarin, D-Limonen, Eugenol, Geraniol oder Linalool oder einen der sonstigen Bestandteile; von Patienten mit bekannter Überempfindlichkeit gegen Acetylsalicylsäure oder nicht-steroidale Antiphlogistika (NSAIDs), die sich in Form von Asthmaanfällen, Bronchospasmus, Urtikaria, akuter Rhinitis oder Angioödem äußern kann; auf offenen Verletzungen, Entzündungen oder Infektionen der Haut, sowie auf Ekzemen oder Schleimhäuten; im letzten Trimenon der Schwangerschaft; bei Kindern und Jugendlichen unter 14 Jahren. Nebenwirkungen: Häufig: Hautausschlag, Ekzem, Erythem, Dermatitis (einschließlich Kontaktdermatitis), Pruritus; Gelegentlich: Schuppenbildung, Austrocknen der Haut, Ödem; Selten: Bullöse Dermatitis; Sehr selten: pustelartiger Hautausschlag; Überempfindlichkeitsreaktionen (einschließlich Urtikaria); Angioödem; Asthma; gastrointestinale Beschwerden; Photosensibilisierung; Häufigkeit nicht bekannt: Bei großflächiger Anwendung kann es zu systemischen Nebenwirkungen kommen. Benzylalkohol, Citronellol, Cumarin, D-Limonen, Eugenol, Geraniol und Linalool können allergische Reaktionen hervorrufen. Warnhinweis: Enthält Propylenglycol, Butylhydroxytoluol und einen Duftstoff mit Eukalyptus, Benzylalkohol, Citronellol, Cumarin, D-Limonen, Eugenol, Geraniol und Linalool. Apothekenpflichtig. Stand: 01/2024 Haleon Germany GmbH, 80258 München
Voltaren Schmerzgel 11,6 mg/g Gel Wirkstoff: Diclofenac-N-Ethylethanamin. Zusammensetzung: 1 g Gel enthält 11,6 mg Diclofenac-N-Ethylethanamin (entspr. 10 mg Diclofenac-Natrium); Sonstige Bestandteile: gereinigtes Wasser; 2-Propanol; Propylenglycol; Cocoylcaprylocaprat (Ph.Eur.); Paraffin; Cetomacrogol; Carbomer 974 P; N-Ethylethanamin; Parfumcreme (enthält Benzylbenzoat). Anwendungsgebiete: Erwachsene: Zur symptomatischen Behandlung von Schmerzen bei akuten Zerrungen, Verstauchungen oder Prellungen in Folge stumpfer Traumen, z. B. Sport- und Unfallverletzungen; Schmerzen der gelenknahen Weichteile (z.B. Schleimbeutel, Sehnen, Sehnenscheiden, Bänder, Muskelansätze und Gelenkkapseln) bei Arthrose der Knie- und Fingergelenke; bei Epicondylitis; bei akuten Muskelschmerzen z. B. im Rückenbereich. Jugendliche ab 14 Jahren: Zur lokalen, symptomatischen Kurzzeitbehandlung von Schmerzen bei akuten Prellungen, Zerrungen oder Verstauchungen infolge eines stumpfen Traumas. Gegenanzeigen: Voltaren Schmerzgel darf nicht angewendet werden bei Überempfindlichkeit gegen den Wirkstoff, Benzylbenzoat, Benzylalkohol, Citral, Citronellol, Cumarin, D-Limonen, Eugenol, Farnesol, Geraniol, Linalool oder einen der sonstigen Bestandteile des Arzneimittels; von Patienten mit bekannter Überempfindlichkeit gegen Acetylsalicylsäure oder nicht-steroidale Antiphlogistika (NSAIDs), die sich in Form von Asthmaanfällen, Bronchospasmus, Urtikaria, akuter Rhinitis oder Angioödem äußern kann; auf offenen Verletzungen, Entzündungen oder Infektionen der Haut sowie auf Ekzemen oder Schleimhäuten; im letzten Trimenon der Schwangerschaft; bei Kindern und Jugendlichen unter 14 Jahren. Nebenwirkungen: Häufig: Hautausschlag, Ekzem, Erythem, Dermatitis (einschließlich Kontaktdermatitis), Pruritus; Gelegentlich: Schuppenbildung, Austrocknen der Haut, Ödem; Selten: Bullöse Dermatitis; Sehr selten: pustelartiger Hautausschlag; Überempfindlichkeitsreaktionen (einschließlich Urtikaria); Angioödem; Asthma; Gastrointestinale Beschwerden; Photosensibilisierung; Häufigkeit nicht bekannt: Bei großflächiger Anwendung über einen längeren Zeitraum kann es zu systemischen Nebenwirkungen kommen. Benzylbenzoat, Benzylalkohol, Citral, Citronellol, Cumarin, D-Limonen, Eugenol, Farnesol, Geraniol und Linalool können allergische Reaktionen hervorrufen. Warnhinweis: Arzneimittel für Kinder unzugänglich aufbewahren! Enthält Propylenglycol und einen Duftstoff mit Benzylbenzoat, Benzylalkohol, Citral, Citronellol, Cumarin, D-Limonen, Eugenol, Farnesol, Geraniol, Linalool. Packungsbeilage beachten. Apothekenpflichtig. Stand: 01/2024 Haleon Germany GmbH, 80258 München
Voltaren 24 Stunden Schmerzpflaster 140 mg wirkstoffhaltiges Pflaster Wirkstoff: Diclofenac-Natrium. Zusammensetzung: Jedes wirkstoffhaltige Pflaster enthält Diclofenac als 140 mg Diclofenac-Natrium; Sonstige Bestandteile: Polyester Vliesstoff; Poly(ethylacrylat-co-methylmethacrylat) (2:1); Tributylcitrat; Butylhydroxyanisol (Ph.Eur.) (E320); Papier, einseitig Silicon-beschichtet. Anwendungsgebiete: Zur lokalen, symptomatischen Kurzzeitbehandlung (max. 7 Tage) von Schmerzen bei akuten Zerrungen, Verstauchungen oder Prellungen der Extremitäten infolge eines stumpfen Traumas bei Jugendlichen ab 16 Jahren und Erwachsenen. Gegenanzeigen: Überempfindlichkeit gegen den Wirkstoff oder einen der sonstigen Bestandteile; Überempfindlichkeit gegen Acetylsalicylsäure oder andere nicht-steroidale Antirheumatika/Antiphlogistika (NSAR); Patienten, bei denen in der Vergangenheit Asthmaanfälle, Hautausschlag oder akute Rhinitis durch Acetylsalicylsäure oder andere nicht-steroidale Antirheumatika/Antiphlogistika (NSAR) ausgelöst wurden; Patienten mit aktivem Ulcus pepticum; Anwendung auf verletzter Haut jeglicher Art: Exsudative Dermatitis, Ekzem, infizierte Verletzungen, Verbrennungen oder Wunden; drittes Trimester der Schwangerschaft; Kindern und Jugendliche unter 16 Jahren. Nebenwirkungen: Häufig: Hautausschlag, Ekzem, Erythem, Dermatitis (einschließlich allergische und Kontaktdermatitis), Pruritus, Brennen an der Applikationsstelle; Reaktionen an der Applikationsstelle; Selten: Bullöse Dermatitis (z.B. Erythema bullosum), trockene Haut; Sehr selten: Pustelartiger Hautausschlag; Überempfindlichkeitsreaktionen (einschließlich Urtikaria), Angioödem, anaphylaktische Reaktion; Asthma; Photosensibilisierung; Häufigkeit nicht bekannt: Bei Anwendung auf einem großen Hautareal und über längere Zeit kann es zu systemischen Nebenwirkungen kommen (wie Magen-, Leber- und Nierenbeschwerden, systemische Überempfindlichkeitsreaktionen). Apothekenpflichtig. Stand: 01/2024 Haleon Germany GmbH, 80258 München
OtriComplex Erkältungskapseln Wirkstoffe: Paracetamol, Phenylephrinhydrochlorid, Guaifenesin. Zusammensetzung: 1 Kapsel enthält 500 mg Paracetamol, 6,1 mg Phenylephrinhydrochlorid (entsprechend 5 mg Phenylephrin) und 100 mg Guaifenesin. Sonstige Bestandteile: Kapselfüllung: Croscarmellose-Natrium; Maisstärke; Natriumdodecylsulfat; Talkum; Magnesiumstearat (Ph.Eur.); Kapselhülle (Größe 0): Gelatine; Indigocarmin (E132); Titandioxid (E171); Chinolingelb (E104); Erythrosin (E127). Anwendungsgebiete: Zur kurzfristigen Behandlung von Erkältung, Schüttelfrost und Grippe, einschließlich leichte bis mäßig starke Schmerzen, Fieber und Schleimhautschwellung der Nase, mit schleimlösender Wirkung bei festsitzendem Erkältungshusten. OtriComplex Erkältungskapseln sind indiziert zur Anwendung bei Erwachsenen und Jugendlichen ab 16 Jahren. Gegenanzeigen: Überempfindlichkeit gegen die Wirkstoffe oder einen der sonstigen Bestandteile; Herzerkrankungen, Hypertonie; Diabetes; Hyperthyreose; Engwinkelglaukom; Phäochromozytom; Patienten, die Monoaminooxidase-Hemmer (MAO-Hemmer) einnehmen oder in den letzten zwei Wochen eingenommen haben, oder trizyklische Antidepressiva oder Betablocker einnehmen; Patienten, die andere Sympathomimetika wie abschwellende Arzneimittel, Appetitzügler und Amphetamin-ähnliche Psychostimulanzien einnehmen. Nebenwirkungen: Aus den umfangreichen Erfahrungen nach der Markteinführung unter therapeutischer/ zugelassener Dosierung berichteten Ereignisse, die Häufigkeit dieser Nebenwirkungen ist nicht bekannt. Erfahrungen zeigen, dass die Nebenwirkungen selten und schwerwiegende Nebenwirkungen sehr selten sind. Paracetamol: Thrombozytopenie, Agranulozytose, Panzytopenie, Leukopenie, Neutropenie (Diese stehen nicht notwendigerweise in einem kausalen Zusammenhang mit Paracetamol); Überempfindlichkeit, einschließlich anaphylaktischer Reaktionen, Angioödem, Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse (In sehr seltenen Fällen wurde über schwerwiegende Hautreaktionen berichtet.); Bronchospasmus (Es gab Fälle von Bronchospasmus unter Paracetamol, allerdings sind diese wahrscheinlicher bei Patienten mit Asthma, die auf Acetylsalicylsäure oder andere NSAR empfindlich reagieren.); Übelkeit, Erbrechen, Durchfall, Oberbauchbeschwerden; Leberfunktionsstörung; Hautausschlag, Pruritus, Erythem, Urtikaria, allergische Dermatitis. Phenylephrin: Überempfindlichkeit, allergische Dermatitis, Urtikaria; Verwirrtheitszustände, Nervosität, Reizbarkeit, Unruhe; Schwindel, Kopfschmerz, Insomnie; Mydriasis, akutes Engwinkelglaukom (Tritt am wahrscheinlichsten bei Patienten mit Engwinkelglaukom auf); Hypertonie, Tachykardie, Palpitationen; Hautausschlag; Übelkeit, Erbrechen, Durchfall; Dysurie, Harnretention (Tritt am wahrscheinlichsten bei Patienten mit Blasenauslassobstruktion auf, wie z. B. Prostatahypertrophie.). Guaifenesin: Überempfindlichkeit, einschließlich anaphylaktischer Reaktionen, Angioödem; Dyspnoe (Dyspnoe wurde im Zusammenhang mit anderen Symptomen einer Überempfindlichkeit berichtet); Übelkeit, Erbrechen, Durchfall, Abdominalbeschwerden; Hautausschlag, Urtikaria. Warnhinweis: Ohne ärztlichen Rat nicht länger anwenden als in der Packungsbeilage vorgegeben! Apothekenpflichtig. Stand: 01/2024. Haleon Germany GmbH, 80258 München
OtriComplex forte Erkältungsgetränk Wirkstoffe: Paracetamol, Phenylephrinhydrochlorid, Guaifenesin. Zusammensetzung: 1 Einzeldosis-Beutel enthält 1000 mg Paracetamol, 12,2 mg Phenylephrinhydrochlorid (entsprechend 10 mg Phenylephrin) und 200 mg Guaifenesin. Sonstige Bestandteile: Saccharose, Natriumcitrat, Citronensäure, Weinsäure (Ph.Eur.), Zitronen-Aroma 87A069, Zitronen-Aroma 875060 (enthält Butylhydroxyanisol), Menthol-Aroma 876026, pulverisiert, Acesulfam-Kalium (E950) Zitronen-Aroma 501476/AP05.04, Aspartam (E951), Zitronen-Aroma 875928, Chinolingelb (E104). Anwendungsgebiete: Zur kurzfristigen Behandlung von Erkältung, Schüttelfrost und Grippe, einschließlich leichte bis mäßig starke Schmerzen, Fieber und Schleimhautschwellung der Nase, mit schleimlösender Wirkung bei festsitzendem Erkältungshusten. OtriComplex forte Erkältungsgetränk ist indiziert zur Anwendung bei Erwachsenen und Jugendlichen ab 16 Jahren. Gegenanzeigen: Überempfindlichkeit gegen die Wirkstoffe oder einen der sonstigen Bestandteile; Herzerkrankungen, Hypertonie; Diabetes; Hyperthyreose; Engwinkelglaukom; Phäochromozytom; Patienten, die Monoaminooxidase-Hemmer (MAO-Hemmer) einnehmen oder in den letzten zwei Wochen eingenommen haben, oder trizyklische Antidepressiva oder Betablocker einnehmen; Patienten, die andere Sympathomimetika wie abschwellende Arzneimittel, Appetitzügler und Amphetamin-ähnliche Psychostimulanzien einnehmen. Nebenwirkungen: Aus den umfangreichen Erfahrungen nach der Markteinführung unter therapeutischer/ zugelassener Dosierung berichteten Ereignisse, die Häufigkeit dieser Nebenwirkungen ist nicht bekannt. Erfahrungen zeigen, dass die Nebenwirkungen selten und schwerwiegende Nebenwirkungen sehr selten sind. Paracetamol: Thrombozytopenie, Agranulozytose, Panzytopenie, Leukopenie, Neutropenie (Diese stehen nicht notwendigerweise in einem kausalen Zusammenhang mit Paracetamol); Überempfindlichkeit, einschließlich anaphylaktischer Reaktionen, Angioödem, Stevens-Johnson-Syndrom und toxische epidermale Nekrolyse (In sehr seltenen Fällen wurde über schwerwiegende Hautreaktionen berichtet.); Bronchospasmus (Es gab Fälle von Bronchospasmus unter Paracetamol, allerdings sind diese wahrscheinlicher bei Patienten mit Asthma, die auf Acetylsalicylsäure oder andere NSAR empfindlich reagieren.); Übelkeit, Erbrechen, Durchfall, Oberbauchbeschwerden; Leberfunktionsstörung; Hautausschlag, Pruritus, Erythem, Urtikaria, allergische Dermatitis. Phenylephrin: Überempfindlichkeit, allergische Dermatitis, Urtikaria; Verwirrtheitszustände, Nervosität, Reizbarkeit, Unruhe; Schwindel, Kopfschmerz, Insomnie; Mydriasis, akutes Engwinkelglaukom (Tritt am wahrscheinlichsten bei Patienten mit Engwinkelglaukom auf); Hypertonie, Tachykardie, Palpitationen; Hautausschlag; Übelkeit, Erbrechen, Durchfall; Dysurie, Harnretention (Tritt am wahrscheinlichsten bei Patienten mit Blasenauslassobstruktion auf, wie z. B. Prostatahypertrophie.). Guaifenesin: Überempfindlichkeit, einschließlich anaphylaktischer Reaktionen, Angioödem; Dyspnoe (Dyspnoe wurde im Zusammenhang mit anderen Symptomen einer Überempfindlichkeit berichtet); Übelkeit, Erbrechen, Durchfall, Abdominalbeschwerden; Hautausschlag, Urtikaria. Warnhinweis: Enthält Saccharose, Natrium und Aspartam (E951). Ohne ärztlichen Rat nicht länger anwenden als in der Packungsbeilage vorgegeben! Apothekenpflichtig. Stand: 01/2024. Haleon Germany GmbH, 80258 München
CHDE/CHVOLT/0063/19b